元紀(jì)事
國(guó)內(nèi)首個(gè)真實(shí)世界證據(jù)支持藥物研發(fā)與審評(píng)的指導(dǎo)文件發(fā)布
文件旨在厘清藥物研發(fā)和監(jiān)管決策中真實(shí)世界證據(jù)的相關(guān)定義,指導(dǎo)真實(shí)世界數(shù)據(jù)收集以及適用性評(píng)估,明確真實(shí)世界證據(jù)在藥物監(jiān)管決策中的地位和適用范圍,探究真實(shí)世界證據(jù)的評(píng)價(jià)原則,為工業(yè)界和監(jiān)管部門(mén)利用真實(shí)世界證據(jù)支持藥物監(jiān)管決策提供參考意見(jiàn)。

業(yè)界和學(xué)界都對(duì)其評(píng)價(jià)頗高。有學(xué)者認(rèn)為這是一個(gè)里程碑式的事件,因?yàn)樗菑谋O(jiān)管理念上的極大的轉(zhuǎn)變,真實(shí)世界研究適應(yīng)了當(dāng)前科學(xué)發(fā)展的方向,將會(huì)是藥品研發(fā)的一個(gè)重要方向。
早在去年5月征求意見(jiàn)稿發(fā)布時(shí),在醫(yī)藥界已經(jīng)引起很大的震動(dòng)。新藥研發(fā)耗時(shí)長(zhǎng)、成本高,從而造成患者負(fù)擔(dān)重,這是世界難題,在降低藥物研發(fā)成本方面,真實(shí)世界研究可謂是為數(shù)不多的創(chuàng)新方向之一。
藥企非常歡迎真實(shí)世界證據(jù),一家跨國(guó)藥企的管理人員認(rèn)為,之前已有很多藥品通過(guò)真實(shí)世界數(shù)據(jù)獲批新適應(yīng)證,以前可能是實(shí)在沒(méi)有辦法的情況下,會(huì)考慮真實(shí)世界數(shù)據(jù),有了政策之后,會(huì)更方便,或更早期去討論使用真實(shí)世界證據(jù)。

《原則》明確,真實(shí)世界證據(jù)是指通過(guò)對(duì)適用的真實(shí)世界數(shù)據(jù)進(jìn)行恰當(dāng)和充分的分析所獲得的關(guān)于藥物的使用情況和潛在獲益-風(fēng)險(xiǎn)的臨床證據(jù),包括通過(guò)對(duì)回顧性或前瞻性觀察性研究或者實(shí)用臨床試驗(yàn)等干預(yù)性研究獲得的證據(jù)。
真實(shí)世界數(shù)據(jù)的常見(jiàn)來(lái)源包括但不限于:衛(wèi)生信息系統(tǒng)(HospitalInformation System,HIS),醫(yī)保系統(tǒng),疾病登記系統(tǒng),國(guó)家藥品不良反應(yīng)監(jiān)測(cè)哨點(diǎn)聯(lián)盟,自然人群隊(duì)列和專(zhuān)病隊(duì)列數(shù)據(jù)庫(kù),組學(xué)相關(guān)數(shù)據(jù)庫(kù),死亡登記數(shù)據(jù)庫(kù),患者報(bào)告結(jié)局?jǐn)?shù)據(jù),來(lái)自移動(dòng)設(shè)備端的數(shù)據(jù)等。
2016年12月美國(guó)通過(guò)的《21世紀(jì)治愈法案》,通常被視為真實(shí)世界證據(jù)支持藥物和其他醫(yī)療產(chǎn)品的監(jiān)管決策、加快醫(yī)藥產(chǎn)品研發(fā)的起點(diǎn)。在這之后,RWS已成為全球相關(guān)監(jiān)管機(jī)構(gòu)、制藥工業(yè)界和學(xué)術(shù)界共同關(guān)注且極具挑戰(zhàn)性的問(wèn)題。
國(guó)家藥監(jiān)局此次《指導(dǎo)原則》的發(fā)布,僅僅比美國(guó)晚了3年,我國(guó)在新藥審評(píng)審批上的創(chuàng)新越來(lái)越快了。
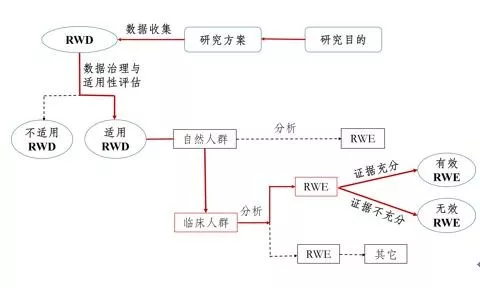
《原則》指出,真實(shí)世界研究是指針對(duì)預(yù)設(shè)的臨床問(wèn)題,在真實(shí)世界環(huán)境下收集與研究對(duì)象健康有關(guān)的數(shù)據(jù)(真實(shí)世界數(shù)據(jù))或基于這些數(shù)據(jù)衍生的匯總數(shù)據(jù),通過(guò)分析,獲得藥物的使用情況及潛在獲益-風(fēng)險(xiǎn)的臨床證據(jù)(真實(shí)世界證據(jù))的研究過(guò)程(如圖1所示)。

圖1支持藥物監(jiān)管決策的真實(shí)世界研究路徑(實(shí)線所示)
真實(shí)世界證據(jù)支持藥物監(jiān)管決策的主要應(yīng)用范圍
真實(shí)世界證據(jù)應(yīng)用于支持藥物監(jiān)管決策,涵蓋上市前臨床研發(fā)以及上市后再評(píng)價(jià)等多個(gè)環(huán)節(jié)。例如,為新產(chǎn)品批準(zhǔn)上市提供有效性或安全性的證據(jù);為已獲批產(chǎn)品修改說(shuō)明書(shū)提供證據(jù),包括增加或修改適應(yīng)證,改變劑量、給藥方案或給藥途徑,增加新適用人群,增加實(shí)效比較信息,增加安全性信息等;作為上市后要求的一部分支持監(jiān)管決策的證據(jù)等。
罕見(jiàn)病藥物準(zhǔn)入、廣譜藥物(例如PD-1抑制劑)新適應(yīng)證審批、中醫(yī)藥再評(píng)價(jià),被認(rèn)為是最快能從《指導(dǎo)原則》中獲益的方向。
真實(shí)世界證據(jù)支持藥物監(jiān)管決策的主要應(yīng)用范圍有:
1.為新藥注冊(cè)上市提供有效性和安全性的證據(jù)
中國(guó)有2000萬(wàn)左右罕見(jiàn)患者。2018年5月,國(guó)家發(fā)布《第一批罕見(jiàn)病目錄》,納入121種罕見(jiàn)病,大約影響300萬(wàn)名患者。截至2018年12月,其中74種在美國(guó)或歐盟、日本等地有162種治療藥品。當(dāng)中只有83種在中國(guó)上市,可治療53種罕見(jiàn)病。
每一種罕見(jiàn)病藥物,幾乎就代表了一個(gè)群體的生存希望。但有一半國(guó)外已獲批的罕見(jiàn)病藥物未能進(jìn)入中國(guó),很重要的原因就在于臨床試驗(yàn)很難完成。
傳統(tǒng)的臨床試驗(yàn)需要一個(gè)實(shí)驗(yàn)組和一個(gè)對(duì)照組,罕見(jiàn)病人本來(lái)就很稀少,想要招募到足夠的病人入組就成了最大的挑戰(zhàn)。
但如果能用真實(shí)世界數(shù)據(jù)來(lái)展示疾病的自然特征,將它和實(shí)驗(yàn)組進(jìn)行對(duì)比,就可以少招募一半的病人,這無(wú)疑會(huì)大大減輕藥企的成本,加快罕見(jiàn)病新藥在國(guó)內(nèi)的注冊(cè)上市。
另外,對(duì)適應(yīng)證很廣譜的藥物,比如像PD-1抑制劑,新藥上市之后,通常有很多超適應(yīng)證用藥的情況,怎么去迅速擴(kuò)展更多適應(yīng)證,真實(shí)世界研究是非常好的一種方法。
2.為已上市藥物的說(shuō)明書(shū)變更提供證據(jù)
對(duì)于已經(jīng)上市的藥物,新增適應(yīng)證通常情況下需要RCT支持。但當(dāng)RCT不可行或非最優(yōu)的研究設(shè)計(jì)時(shí),采用PCT或觀察性研究等生成的真實(shí)世界證據(jù)支持新增適應(yīng)癥可能更具可行性和合理性。
增加或者修改適應(yīng)證;改變劑量、給藥方案或者用藥途徑;增加新的適用人群;添加實(shí)效比較研究的結(jié)果;增加安全性信息;說(shuō)明書(shū)的其他修改。
3.為藥物上市后要求或再評(píng)價(jià)提供證據(jù)
基于RCT證據(jù)獲批的藥物,通常由于病例數(shù)較少、研究時(shí)間較短、試驗(yàn)對(duì)象入組條件嚴(yán)格、干預(yù)標(biāo)準(zhǔn)化等原因,存在安全性信息有限、療效結(jié)論外推不確定、用藥方案未必最優(yōu)、經(jīng)濟(jì)學(xué)效益缺乏等不足,需要利用真實(shí)世界數(shù)據(jù)對(duì)藥物在真實(shí)醫(yī)療實(shí)踐中的效果、安全性、使用情況,以及經(jīng)濟(jì)學(xué)效益等方面進(jìn)行更全面的評(píng)估,并不斷根據(jù)真實(shí)世界證據(jù)做出決策調(diào)整。
4.名老中醫(yī)經(jīng)驗(yàn)方、中藥醫(yī)療機(jī)構(gòu)制劑的人用經(jīng)驗(yàn)總結(jié)與臨床研發(fā)
對(duì)于名老中醫(yī)經(jīng)驗(yàn)方、中藥醫(yī)療機(jī)構(gòu)制劑等已有人用經(jīng)驗(yàn)藥物的臨床研發(fā),在處方固定、生產(chǎn)工藝路線基本成型的基礎(chǔ)上,可嘗試將真實(shí)世界研究與隨機(jī)臨床試驗(yàn)相結(jié)合,探索臨床研發(fā)的新路徑。
5.真實(shí)世界證據(jù)用于監(jiān)管決策的其他應(yīng)用,包括指導(dǎo)臨床研究設(shè)計(jì)和精準(zhǔn)定位目標(biāo)人群等。
真實(shí)世界研究的意義和價(jià)值
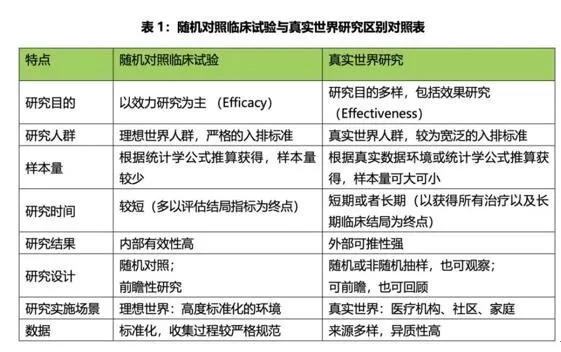
相對(duì)于傳統(tǒng)的藥物臨床試驗(yàn)的隨機(jī)對(duì)照試驗(yàn)(RandomizedControlled Trial,RCT)方法,在評(píng)價(jià)藥物安全性和有效性時(shí)常常會(huì)帶來(lái)時(shí)間久、成本高的代價(jià),如業(yè)內(nèi)共識(shí)一款新藥平均研發(fā)10年、成本10億美金的說(shuō)法,最近幾年,這個(gè)成本還在上升。
而真實(shí)世界研究,不僅可以利用真實(shí)世界數(shù)據(jù)支持審評(píng),可以部分取代目前藥物研發(fā)中的臨床試驗(yàn),節(jié)省藥物研發(fā)成本。
此外,真實(shí)世界數(shù)據(jù)有些是前瞻性的,也有一些是回顧性的,基于歷史數(shù)據(jù)進(jìn)行注冊(cè)審批,還能縮減藥品審批上市的時(shí)間,因此受到藥企歡迎。

RCT與RWE對(duì)比(來(lái)源:《真實(shí)世界研究指南2018版》)
基于此,《原則》中也列舉了兩項(xiàng)真實(shí)世界證據(jù)的研究案例:
示例1:利用真實(shí)世界證據(jù)支持新增適應(yīng)證
申辦方在某藥上市后發(fā)起一項(xiàng)通過(guò)真實(shí)世界數(shù)據(jù)評(píng)價(jià)其在中國(guó)女性中減少臨床骨質(zhì)疏松性骨折的有效性和安全性研究。
該研究遵循真實(shí)世界研究的良好實(shí)踐,研究方案事先公開(kāi)。真實(shí)世界數(shù)據(jù)來(lái)源具有良好的研究人群代表性,樣本量達(dá)4萬(wàn)余人。
該研究的主要終點(diǎn)通過(guò)病歷審查進(jìn)行驗(yàn)證,以?xún)A向評(píng)分匹配作為主要分析方法,同時(shí)使用逆概率加權(quán)法、高維傾向評(píng)分調(diào)整等多種方法進(jìn)行敏感性分析,并定量評(píng)估未測(cè)量到的混雜因素的影響。
該真實(shí)世界研究的結(jié)果與全球RCT研究相近,并用不同數(shù)據(jù)來(lái)源、不同研究機(jī)構(gòu)的真實(shí)世界數(shù)據(jù)重現(xiàn)出該結(jié)果。

示例2:利用真實(shí)世界證據(jù)支持?jǐn)U大聯(lián)合用藥

真實(shí)世界中患者所聯(lián)合的化療方案并不局限于卡鉑與紫杉醇,還包括培美曲塞聯(lián)合鉑類(lèi)、吉西他濱聯(lián)合順鉑等。2018年10月該藥獲批將治療方案擴(kuò)展為聯(lián)合以鉑類(lèi)為基礎(chǔ)的化療方案,其中三項(xiàng)真實(shí)世界研究結(jié)果提供了強(qiáng)有力的支持證據(jù)。
這三項(xiàng)研究回顧性分析了山東省腫瘤醫(yī)院、江蘇省腫瘤醫(yī)院和中國(guó)醫(yī)學(xué)科學(xué)院腫瘤醫(yī)院三家醫(yī)院的真實(shí)世界患者數(shù)據(jù),均顯示在含鉑雙藥化療基礎(chǔ)上聯(lián)合貝伐珠單抗較單純化療顯著延長(zhǎng)PFS和OS,與全球人群數(shù)據(jù)具有一致性,并且未發(fā)現(xiàn)新的安全性問(wèn)題。
此外,相關(guān)真實(shí)世界研究還提供了EGFR突變和腦轉(zhuǎn)移等不同患者亞組中的療效數(shù)據(jù),從多角度證實(shí)了貝伐珠單抗聯(lián)合療法的有效性和安全性。
真實(shí)世界數(shù)據(jù)指導(dǎo)細(xì)則正在研討推進(jìn)
真實(shí)世界證據(jù)對(duì)藥物研發(fā)來(lái)說(shuō),最直接的價(jià)值就是降低成本。新藥研發(fā)時(shí)間長(zhǎng)、成本高、成功率低,多年前就有一款新藥平均研發(fā)10年、成本10億美金的說(shuō)法,最近幾年成本還在上升。

這也是藥企歡迎真實(shí)世界證據(jù)的原因之一,前述跨國(guó)藥企的管理人員說(shuō),對(duì)于新藥研發(fā),真實(shí)世界證據(jù)可以在一定程度上減少Ⅲ期臨床試驗(yàn)的成本;對(duì)于擴(kuò)適應(yīng)證的藥品,可以直接免去Ⅲ期臨床試驗(yàn)。

有專(zhuān)業(yè)人士認(rèn)為,對(duì)于符合真實(shí)世界證據(jù)要求的企業(yè)來(lái)講,它的成本和時(shí)間將會(huì)急劇的降低,尤其是廣譜藥拓適應(yīng)證,用真實(shí)世界證據(jù)非常好,不過(guò)隨機(jī)對(duì)照臨床試驗(yàn)還會(huì)是新藥上市的主流,真實(shí)世界證據(jù)作為輔助和補(bǔ)充。
在政策初期,藥企如果可以負(fù)擔(dān)隨機(jī)對(duì)照臨床研究,可能還是會(huì)優(yōu)先選擇隨機(jī)對(duì)照臨床研究,畢竟真實(shí)世界證據(jù)還需要不斷進(jìn)一步驗(yàn)證。政策實(shí)施之后,會(huì)有很多的企業(yè)會(huì)去嘗試發(fā)起真實(shí)世界研究,但最終能真正有效可靠的證據(jù)不會(huì)太多,這是因?yàn)樽鳛檎鎸?shí)世界研究前提的真實(shí)世界數(shù)據(jù)基礎(chǔ)還不夠。

真實(shí)世界研究,有些是前瞻性的,也有一些是回顧性的,基于歷史數(shù)據(jù)進(jìn)行注冊(cè)審批。基于歷史數(shù)據(jù)的研究并不完全取決于企業(yè)本身是否有能力,更重要的是目前數(shù)據(jù)的可獲得性,以及它們的質(zhì)量能否滿(mǎn)足注冊(cè)的需要。
過(guò)去,醫(yī)療系統(tǒng)內(nèi)的數(shù)據(jù)本就不是為了注冊(cè)需要,主要是出于監(jiān)管的需要,比如醫(yī)保系統(tǒng)首要是為了滿(mǎn)足醫(yī)保作為支付監(jiān)管的任務(wù),但真實(shí)世界研究需要注冊(cè)申請(qǐng)、評(píng)估效果、說(shuō)明產(chǎn)品有效性、安全性的數(shù)據(jù),原有系統(tǒng)的數(shù)據(jù)豐富程度還不夠。
不過(guò),《指導(dǎo)原則》中大篇幅地提出了對(duì)于真實(shí)世界數(shù)據(jù)的表述,包括數(shù)據(jù)相關(guān)性和可靠性的評(píng)估以及統(tǒng)計(jì)方法和研究方法的介紹,說(shuō)明監(jiān)管部門(mén)在政策的制定上非常落地。
如果說(shuō)《指導(dǎo)原則》的出臺(tái)是為真實(shí)世界證據(jù)的應(yīng)用確立了規(guī)范,那么接下來(lái)政策的順利落地還將需要更多的細(xì)則和標(biāo)準(zhǔn)。據(jù)了解,關(guān)于真實(shí)世界數(shù)據(jù)的指導(dǎo)細(xì)則也研討推進(jìn)中,規(guī)定什么樣的真實(shí)世界數(shù)據(jù)可以獲得真實(shí)世界證據(jù),進(jìn)而拓展適應(yīng)證。





